La Unidad de Investigación Clínica (UIC) constituye una unidad de apoyo transversal para la realización de estudios de investigación clínica, dando soporte a toda Gipúzcoa aunque su ámbito principal de referencia es la Organización Sanitaria Integrada (OSI) Donostialdea, que incluye el Hospital Universitario Donostia y centros de Atención Primaria de la comarca de San Sebastián.
Está integrada por un conjunto de profesionales de carácter multidisciplinar, quienes aportan su conocimiento y experiencia para brindar apoyo científico y técnico a la investigación clínica con medicamentos y productos sanitarios.
Contacto para inicio/puesta en marcha de centro para un ensayo clínico:
Contacto para soporte de actividades científico-técnicas en un ensayo clínico:

Responsable de área
IOANA RIAÑO FERNANDEZ
Responsable de Plataforma
0000-0001-8410-2706
Miembros


MARÍA TERESA REVILLA GUARINOS

MARIA DEL PILAR ETXART LASA
KORO ANDUEZA GRANADOS

OSWALDO GOROSABEL LARRAÑAGA

MARIA SONIA ARBIDE LABORDE
LARA ALAMEDA CALVO

JULEN SARRIONANDIA SAEZ DE OJER

EDURNE ALMANDOZ CORTAJARENA

MARIA AURORA BARBERO MARTINEZ

OLAIA JANDULA GOMEZ

MARIA DE LA MONTAÑA RIVAS MONTERO

NEREA CASTROAGUDIN ROMERO
CLAUDIA NEVADO PAVON

ALEJANDRA MARIA PATIÑO TRIVES

OHIANA BERROYA COTADO
MARÍA DÍEZ ZUBIZARRETA

ASIER IRIONDO ETURA

ANA MANUEL CANO

MIKEL PEREZ ARRIETA
CLARA LARRUMBIDE MERINO
Tarifas
Redes y certificados
- SCReN (Spanish Clinical Research Network)

- ECRIN (European Clinical Research Infraestructures Network)

- CERTERA (State Network Consortium for the Development of Advanced Therapy Medicines)

- VACCELERATE (Red de investigación clínica para la aceleración de ensayos de vacunas en Europa)

Certificados
La plataforma gestiona sus procesos siguiendo las directrices de la Norma UNE-EN ISO 9001:2015 estando su Sistema de Gestión de Gestión de la Calidad certificado por AENOR, lo que supone un valor añadido a la labor desempeñada por la Plataforma, sobre todo de cara a los peticionarios externos de sus servicios, aportando confianza sobre el grado de Calidad que se aplica en el tratamiento de sus solicitudes.

Preguntas frecuentes
Para investigadores
¿Qué trámites he de completar para desarrollar mi estudio/ensayo clínico en el centro?
Es necesario que los investigadores completen un informe de pertinencia en el que plasmen la información relevante, interés en participar en el estudio y el personal y/o servicios que van a participar en el mismo. Este documento se ha de enviar firmado para su revisión final y se le proporcionará por el área de gestión de la unidad.
Además, tendrás que firmar el contrato de ejecución del estudio y contar con las aprobaciones pertinentes.
¿Qué otros servicios puedo obtener en la unidad de investigación clínica?
La unidad cuenta con dos áreas de especial interés para los investigadores que participen en estudios o ensayos clínicos:
Área científico técnica que puede dar soporte en tareas de puesta en marcha, gestión, desarrollo y seguimiento de estudios y ensayos clínicos.
Área de enfermería y muestras biológicas que puede dar soporte en la ejecución del estudio.
¿Cómo puedo solicitar el apoyo de la unidad de investigación clinica?
Si necesitas apoyo en el ámbito de investigación clínica para el desarrollo de estudios clínicos puedes contactar con la adjunta o con la responsable de la unidad.
Si necesitas apoyo del área de enfermería y muestras biológicas puedes contactar con la coordinadora del área.
Y siempre contarás con cualquier integrante de la unidad que encauzará o guiará en el proceso, así como en la dirección de correo:
¿Qué firmas son válidas para los contratos de ejecución de estudios y ensayos clínicos?
Es necesario contar con una firma electrónica con certificado digital que tenga validez jurídica (certificado digital emitido por un prestador de servicios de confianza cualificado). Los profesionales de Osakidetza cuentan con la posibilidad de obtener una firma electrónica. También son válidas las firmas que puedes realizar con tu DNI electrónico o con IZENPE.
En la unidad podemos facilitar un manual que hemos elaborado para facilitar su obtención a través de Osakidetza.
Para empresas
¿Qué documentación es necesaria para la puesta en marcha del ensayo/estudio en el centro?
Es necesaria la autorización del centro que se vehiculiza a través de la firma de un contrato firmado entre las partes implicadas. Puedes acceder a los modelos de contratos aquí. Estos modelos, van acompañados de unos requisitos de documentación a aportar por el promotor.
Podemos tramitar el contrato paralelamente a la obtención de las aprobaciones pertinentes, pero para que éste sea liberado y pueda realizarse la visita de inicio se ha de contar con las aprobaciones, seguro del estudio y versión aprobada del protocolo.
¿Cómo solicitar la tramitación de la idoneidad de instalaciones?
Puedes solicitar el documento de idoneidad de instalaciones en:
¿Qué servicios puedo contratar en la plataforma de investigación clínica?
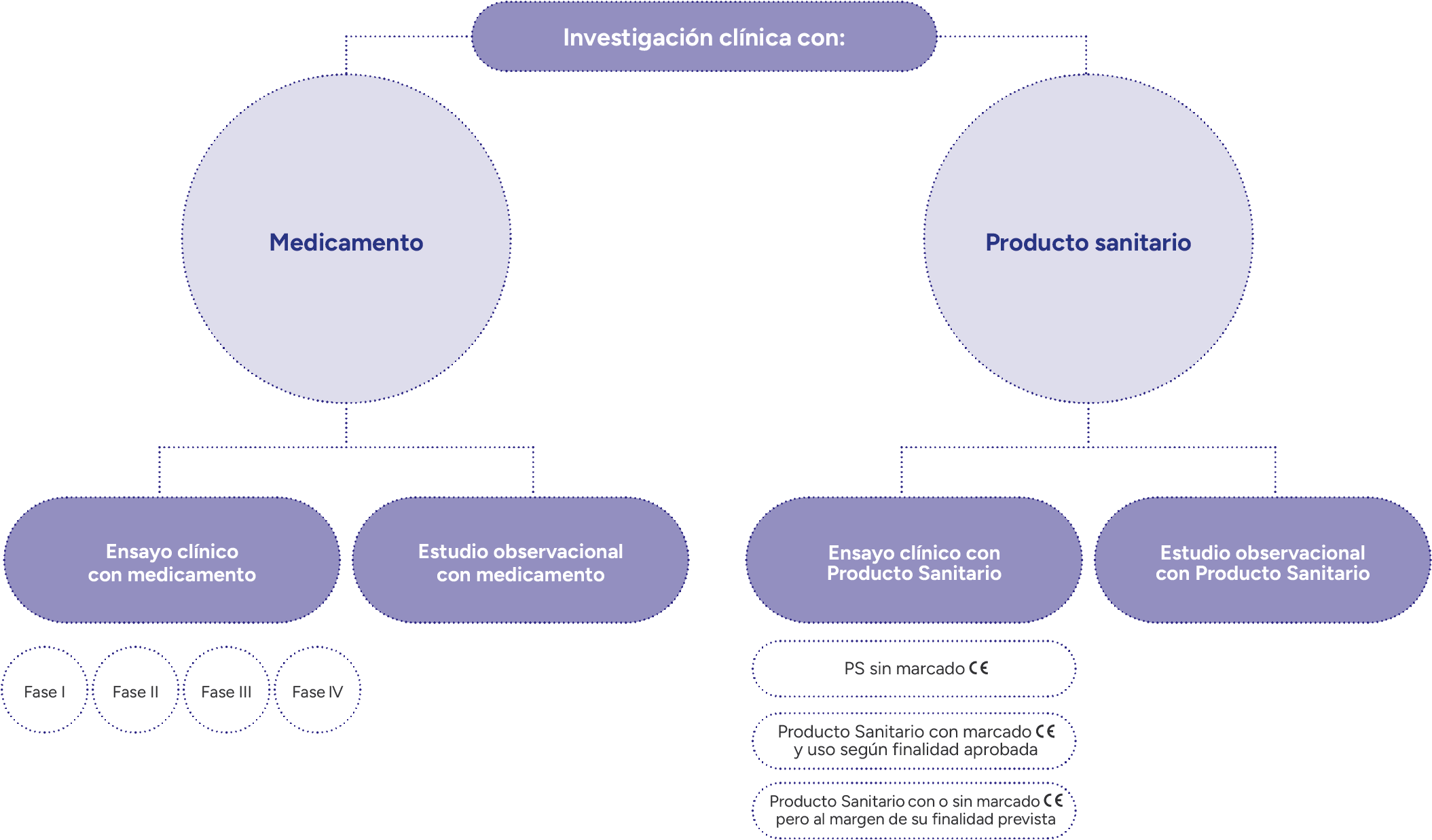
Contamos con perfiles especializados en la puesta en marcha, gestión, seguimiento y desarrollo de ensayos clínicos con medicamento, producto sanitario y otro tipo de intervenciones, y con tarifas para prestar este servicio a promotores externos. Además, desde la plataforma ayudamos a identificar e involucrar investigadores interesados en colaborar con el sector empresarial desde el diseño y la realización de ensayos clínicos hasta la participación en los mismos.